A partir da experiência adquirida junto a clientes e parceiros, o Laboratório CENIC identificou que as maiores dificuldades em relação ao relatório técnico exigido como um dos documentos do registro da Anvisa são:
• Não apresentar ensaios para comprovação da segurança e eficácia;
• Não realizar ensaio no caso mais crítico (pior caso);
• Apresentar ensaios parciais sem avaliação crítica;
• Ausência de avaliação crítica.
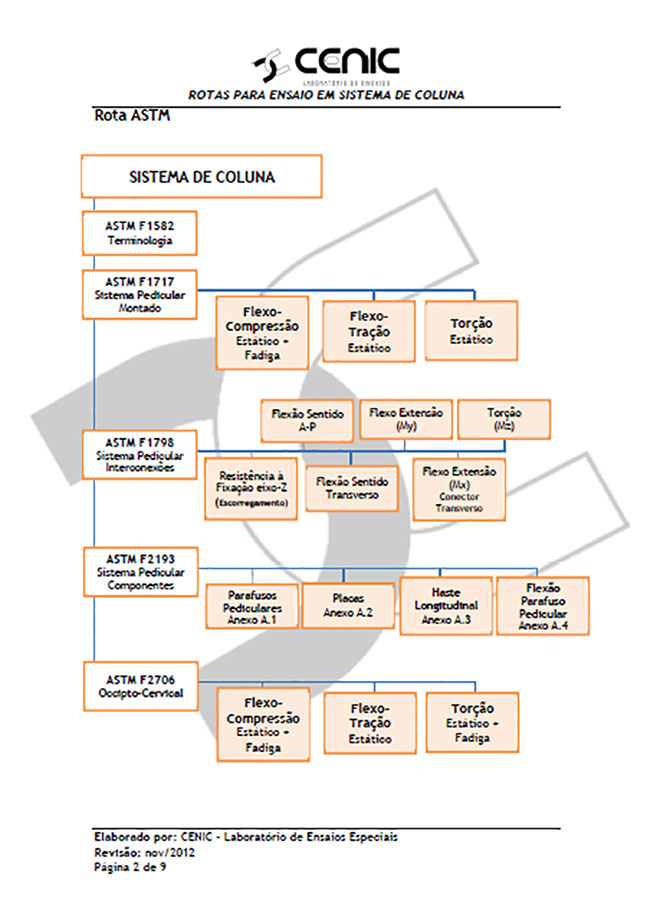
A partir dessas dificuldades, o Laboratório CENIC passou a oferecer dois novos serviços: ROTAS DE ENSAIO e assessoria em ANÁLISE CRÍTICA de resultados.
O que é e para que serve a análise crítica?
As agências regulatórias, de um modo geral, exigem que seja comprovada a segurança e eficácia de um implante ortopédico. Dessa forma, fabricantes e importadores responsáveis pelo registro de um determinado produto, precisam não apenas apresentar resultados de ensaio, mas também interpretar e contextualizar os resultados obtidos para o seu produto, indicando por meio de uma análise crítica se o produto tem características satisfatórias.
Cada agência regulatória tem suas peculiaridades, mas todas esperam alguma discussão a cerca dos resultados de ensaio. Essa discussão pode ser baseada em comparações de resultados de trabalhos científicos, de literatura técnica de desenvolvimento, cálculos biomecânicos e outras fontes de consulta.
ESCLARECIMENTO SOBRE O RESPONSÁVEL DA ANÁLISE CRÍTICA:
O Regulamento técnico anexo à RDC n° 185 de 22/10/01 estabelece em sua Parte 3, item 5b, que as informações descritas nos Anexos III.A, III.B e III.C devem ser declaradas e assinadas pelo responsável técnico.
O Anexo III.C define as informações do relatório técnico. O item 1.6 do Anexo III.C, mais especificamente, trata da comprovação da segurança e eficácia, que deve ser conduzida com base na RDC nº 56/2001, que estabelece os requisitos essenciais de segurança e eficácia aplicáveis aos produtos para saúde.
Declarar e assinar afirmações se o produto é bom ou ruim, a partir de resultados de ensaio, é uma das ferramentas comumente utilizadas como comprovação de segurança e eficácia e portanto, conforme definido pela RDC n° 185, é competência do responsável técnico e não do Laboratório de ensaio.
Dessa forma, a assessoria do Laboratório CENIC pode ser definida como um serviço de orientação e discussão a cerca de qual melhor raciocínio ou argumentação pode ser considerada pelo responsável técnico na elaboração da análise crítica.

 Entre em
Entre em 



